
“天河”系列超级计算机应用成果报道——新冠病毒刺突蛋白与宿主ACE2受体亲和力研究
席卷全球的新冠病毒肺炎(COVID-19)是由SARS-CoV-2病毒引起的。新冠病毒的刺突蛋白位于病毒表面,介导病毒与宿主细胞ACE2受体的结合,从而帮助病毒入侵和感染宿主,并因此成为许多疫苗和抗体药物的靶点。研究发现,新冠病毒刺突蛋白的受体结构域(RBD)与ACE2受体的结合能力比2003年的非典SARS-CoV病毒更强。然而,在刺突蛋白全长结构上的研究却表明,新冠病毒的ACE2结合能力比非典SARS-CoV病毒弱,但这种差异的分子机制尚不清楚。
中国科学院上海药物研究所药物发现与设计中心朱维良研究员团队基于天河系列超级计算机资源开展了新冠病毒刺突蛋白与宿主ACE2受体亲和力研究,其成果发表在J. Phys. Chem. Lett.,论文共同第一作者为中科院上海药物研究所博士研究生彭诚和朱正诞,通讯作者为徐志建副研究员和朱维良研究员。
应用成果
冷冻电子显微镜研究表明,刺突蛋白具有多种不同的构象状态,只有当其处于'向上'的打开状态时,它的RBD结构才能与宿主ACE2受体结合。因此,刺突蛋白全长结构和局部RBD结构的ACE2结合能力差异可能与其构象的动态变化过程有关。然而,目前刺突蛋白与ACE2受体结合的动态行为尚未明确,实验观测到的其全长结构与RBD结构域的ACE2结合能力又相互矛盾,这使得目前刺突蛋白与ACE2的作用机制研究就像身处迷雾窥探庐山,横看成岭侧看成峰。
为了拨开这团迷雾,朱维良研究员团队通过计算模拟手段研究了新冠病毒刺突蛋白的动态构象变化,计算了刺突蛋白在处于不同构象形态时的宿主ACE2结合能力,揭示了RBD结构域及全长蛋白与ACE2亲和力差异的分子机制,并预测了多个潜在的药物结合位点。
研究人员首先通过他们开发的高效分子动力学模拟方法NUMD及vsREMD,观测到了新冠病毒刺突蛋白从‘向下’转变到‘向上’的构象变化全过程,并发现刺突蛋白需要打开到一定角度(52.2°)才能与宿主ACE2结合(图1)。在这一构象转变中,作者还发现随着刺突蛋白‘向上’的角度越大,刺突蛋白与宿主ACE2的结合能力也变得越强。此外,相比SARS-CoV病毒,新冠病毒刺突蛋白呈现‘向上’构象的比例更少,转变成‘向上’状态的能垒也更高。这一结果表明,尽管新冠病毒刺突蛋白的RBD结构域具有比SARS-CoV病毒更强的宿主ACE2结合能力,但新冠病毒更不容易从‘向下’转变成‘向上’状态,导致其全长结构的ACE2结合能力与SARS-CoV病毒相当或者更弱。

图1 新冠病毒与SARS-CoV病毒的刺突蛋白构象变化自由能图景以及相应的自由能变化
为了研究刺突蛋白与ACE2受体作用模式的动态变化,研究人员选取了4个不同RBD张开角度的刺突蛋白,计算了它们与ACE2结合时关键残基的能量贡献(图2)。结果发现,新冠病毒刺突蛋白上存在至少14个关键残基共同作用于ACE2受体,其中残基Y449、G496、T500、N501和G502能与ACE2形成稳定的氢键作用,而残基F456和Y489能与ACE2形成稳定的疏水作用。
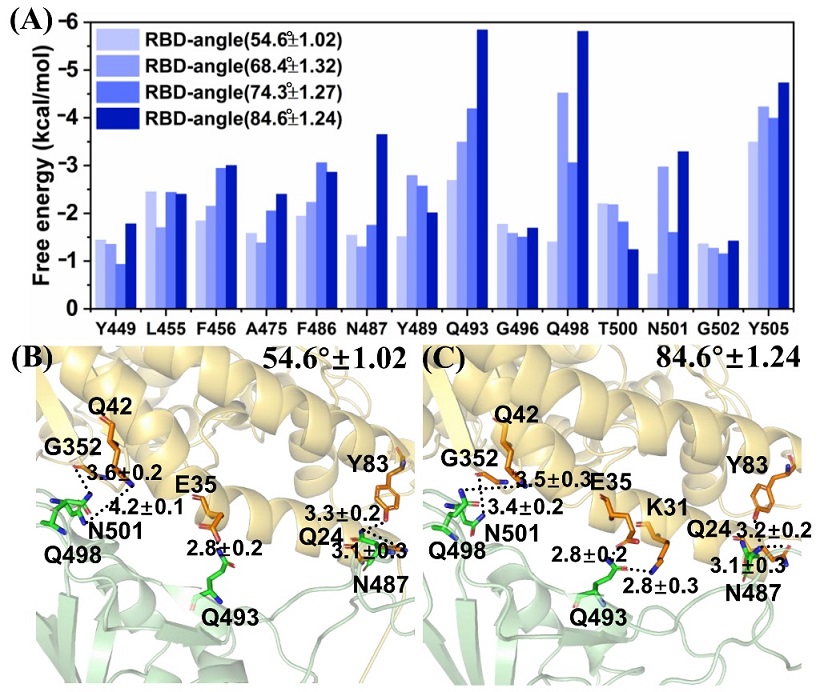
图2 新冠病毒与SARS-CoV病毒的刺突蛋白与宿主ACE2相互作用关键残基
此外,研究人员运用发展的成药性结合位点预测方法D3Pockets,分析了刺突蛋白在构象转变过程中的口袋变化,以探寻具有高稳定性、强相关性的正构或别构口袋(图3)。结果发现了5个与刺突蛋白构象变化运动相关的口袋,可用于刺突蛋白的虚拟筛选。这5个口袋也加入到他们之前针对新冠病毒发展的虚拟筛选平台中
(D3Targets-2019-nCoV:https://www.d3pharma.com/D3Targets-2019-nCoV/index.php),可开展基于网络的分子对接虚拟筛选研究。
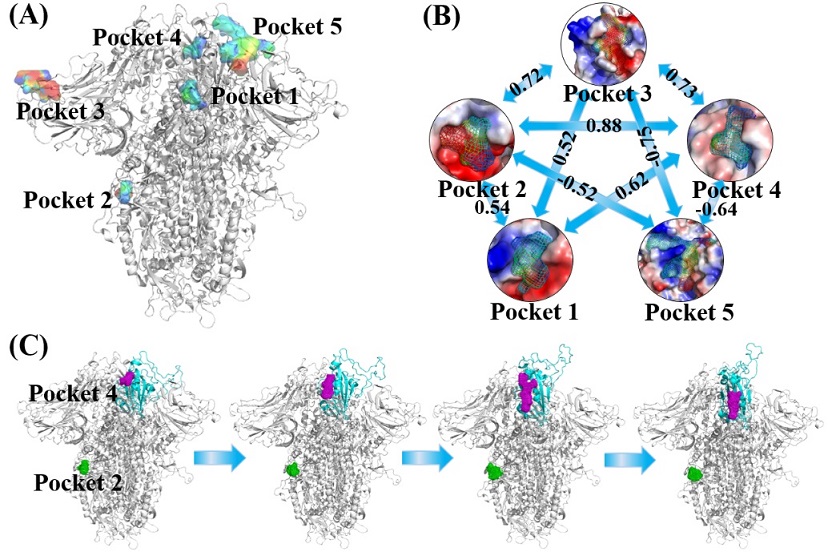
图3 新冠病毒刺突蛋白上的5个运动相关口袋
上述研究工作得到了国家重点研发计划项目的支持。论文的部分分子动力学模拟工作得到了国家超级计算天津中心的大力支持。